Mundo
Estudo revela como enzima amplia instabilidade genética em câncer de mama hormônio-dependente
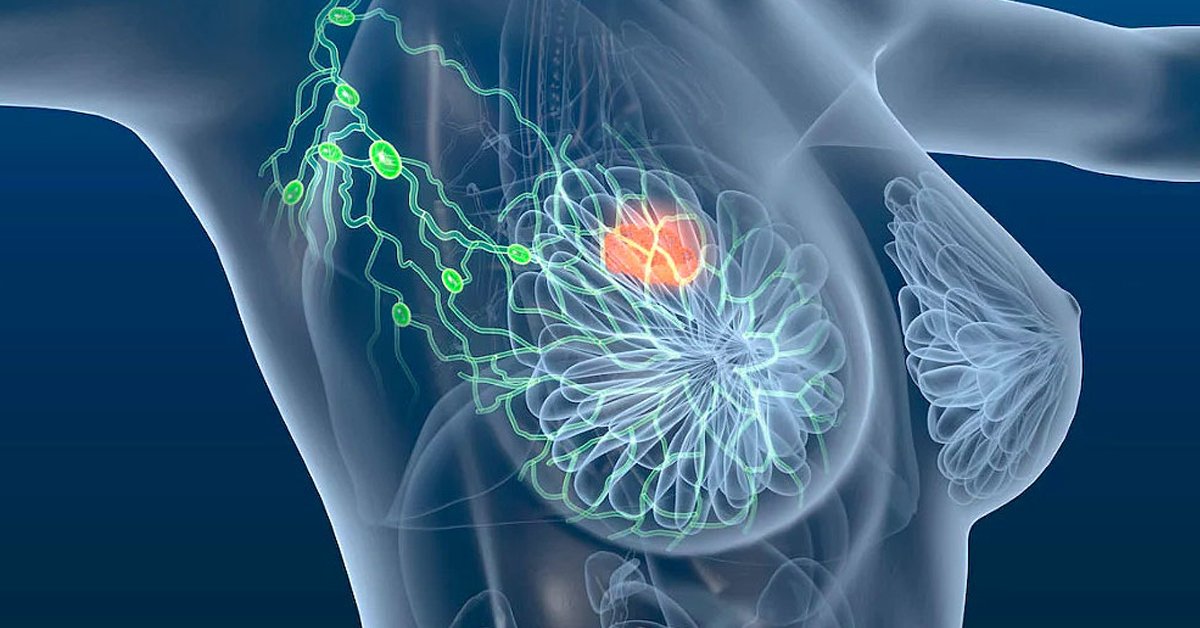
Estudo publicado na revista Nature Communications mostra que a enzima APOBEC3B edita estruturas híbridas de DNA e RNA, favorece quebras duplas no genoma e intensifica a ação do receptor de estrogênio
Imagem reprodução
Um estudo internacional publicado nesta quarta-feira (18), na revista Nature Communications, lança nova luz sobre um dos mecanismos centrais da instabilidade genética no câncer de mama hormônio-dependente. Pesquisadores demonstraram que a enzima APOBEC3B (A3B), já conhecida por induzir mutações em tumores, atua diretamente sobre estruturas chamadas R-loops — híbridos de DNA e RNA formados durante a transcrição gênica — para modular a atividade do receptor de estrogênio (ER) e gerar quebras duplas no DNA.
O trabalho foi liderado por cientistas do Institute of Cancer Research, em Londres, em colaboração com instituições da China, incluindo a Guangdong University of Technology e a Chinese Academy of Agricultural Sciences.
O que o estudo mostra
Utilizando sequenciamento de genoma completo (WGS) em células de câncer de mama ER-positivas, os pesquisadores criaram um modelo experimental com deficiência na via de reparo por excisão de bases (BER), o que permitiu capturar diretamente os locais de edição da A3B — algo até então mascarado pelos sistemas naturais de correção do DNA.
Os resultados indicam, que houve aumento significativo de mutações C>T fora de regiões CpG nas células com A3B ativa. As mutações se concentraram em regiões regulatórias, como promotores e enhancers, e não predominantemente em genes codificadores. A assinatura mutacional observada corresponde ao padrão SBS2, típico da família APOBEC. Mais de 50% dos sítios de ligação da A3B induzidos por estrogênio se localizaram próximos a R-loops. Cerca de 30% de todas as quebras duplas detectáveis no genoma basal foram induzidas pela ativação do receptor de estrogênio (E2). Entre as quebras induzidas por E2, 88% das modificadas pela depleção de A3B coincidiram com quebras dependentes do hormônio.
Segundo os autores, 98,6% dos sítios de quebras duplas modificadas pela A3B coincidiam com regiões previamente identificadas de ligação da enzima.
Características do DNA em mesoescala impactam APOBEC3A e APOBEC3B desaminase ...
“A formação de R-loops cria DNA de fita simples exposto, que serve como substrato ideal para a A3B”, afirmam os pesquisadores no artigo. “Demonstramos que a edição nesses locais é essencial para a geração de quebras duplas associadas à ativação do receptor de estrogênio.”
Contexto histórico
Desde os anos 1990, sabe-se que o estrogênio (17- estradiol) está associado ao risco de câncer de mama, ovário e endométrio. Estudos posteriores mostraram que a ativação do receptor de estrogênio pode induzir quebras duplas no DNA, contribuindo para instabilidade cromossômica.
A APOBEC3B, por sua vez, foi identificada na década de 2010 como uma das principais responsáveis pela chamada “assinatura APOBEC” em genomas tumorais — caracterizada por mutações C>T e C>G em contextos específicos (5’-TCW). Sua superexpressão já havia sido observada em mais de 50% dos tumores primários de mama.
O novo estudo conecta diretamente esses dois fenômenos.
Como ocorre o processo
De acordo com o modelo proposto:
1. O estrogênio ativa o receptor ER.
2. A ativação promove formação de R-loops em regiões regulatórias.
3. A A3B é recrutada e desamina citosinas no DNA de fita simples exposto.
4. O reparo dessas lesões pelas vias BER e TC-NER (reparo por excisão de nucleotídeos acoplado à transcrição) converte os danos em quebras duplas.
5. O reparo subsequente remodela a cromatina e favorece a transcrição gênica.
Quando os pesquisadores bloquearam a conversão das lesões induzidas pela A3B em quebras duplas, observaram que 87% dos genes regulados por estrogênio tiveram sua resposta atenuada.
“Essas quebras não são apenas um subproduto do dano genético; elas parecem fazer parte do mecanismo de regulação transcricional”, destacam os autores.
Impacto social e clínico
O câncer de mama é o tipo mais frequente entre mulheres no mundo. Segundo estimativas globais recentes, são mais de 2 milhões de novos casos por ano. A maioria é classificada como ER-positiva.
A descoberta tem implicações importantes: ajuda a explicar como tumores ER-positivos acumulam heterogeneidade genética. Sugere que a A3B pode ser um alvo terapêutico. Indica que bloquear o processamento das lesões por uracila pode reduzir a atividade proliferativa mediada por estrogênio.
O estudo também discute a alta prevalência, em populações do Sudeste Asiático, de uma deleção germinativa que elimina o gene APOBEC3B (?A3B). Apesar da ausência de alterações endócrinas evidentes nesses indivíduos, os autores sugerem que tumores podem desenvolver dependência específica da A3B no contexto de estresse replicativo.
Perspectivas
Os pesquisadores defendem que futuras investigações devem explorar o papel da A3B em outros receptores nucleares. Avaliar a interação entre A3B e topoisomerases. Testar inibidores específicos da A3B em modelos de câncer ER-positivo. Investigar o impacto clínico do genótipo ?A3B na resposta terapêutica.
Ao demonstrar que a enzima não atua apenas como geradora de mutações aleatórias, mas como co-reguladora funcional da transcrição hormonal, o estudo redefine o papel da APOBEC3B na biologia tumoral.
A conclusão dos autores é direta: a instabilidade genética em tumores hormônio-dependentes não é mero acidente molecular — pode ser parte integrante do programa de ativação gênica impulsionado pelo estrogênio.
Referência
Zhang, C., Lu, Yj., Chen, B. et al. A edição do laço R pela desaminase de citosina do DNA APOBEC3B modula a atividade dos intensificadores do receptor de estrogênio. Nat Commun (2026). https://doi.org/10.1038/s41467-026-69679-4